[211At]MABG vs [131I]MIBG:靶向嗜铬细胞瘤的“头对头”疗效对比研究

摘要图
01. 背景及简介
2025年7月,韩国放射与医学科学院(KIRAMS)Lim Hwisoo研究员团队在《Molecular Pharmaceutics》期刊正式发表题为“Comprehensive Head-to-Head Study between Meta-[211At]astato-benzylguanidine and Meta-[131I]iodo-benzylguanidine in Pheochromocytoma”的研究论文。本研究首次系统对比了α核素药物[211At]MABG与β核素药物[131I]MIBG在嗜铬细胞瘤治疗中的疗效,发现[211At]MABG在细胞摄取率、DNA损伤、抑瘤效果和生存期改善等方面均显著优于[131I]MIBG,且仅需后者1/20的剂量即可实现更强效应。该研究为[211At]放射药物在神经内分泌瘤等适应症上的临床转化提供了坚实的数据支撑,展示出α核素在精准肿瘤放射性治疗领域的巨大潜力。

02. 研究方法
研究者首先合成了α核素药物[211At]MABG,并通过高效液相色谱(HPLC)纯化和抗坏血酸稳定化处理,制备成注射液。通过体外实验评估其在嗜铬细胞瘤PC-12细胞中的摄取、克隆形成能力及DNA损伤情况(Comet assay)。在体内,小鼠荷瘤模型用于比较[211At]MABG与[131I]MIBG的组织分布、肿瘤摄取、抑瘤效果、生存期、体重变化,并通过免疫组化(Ki-67、PCNA、TUNEL)检测肿瘤增殖与凋亡情况。实验中还评估了抗坏血酸对[211At]MABG稳定性的影响。
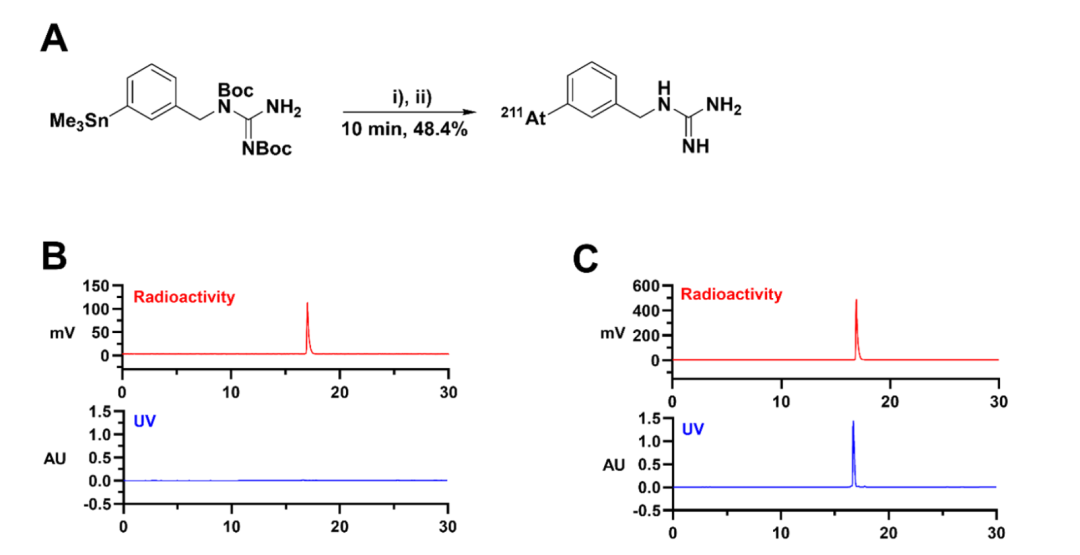
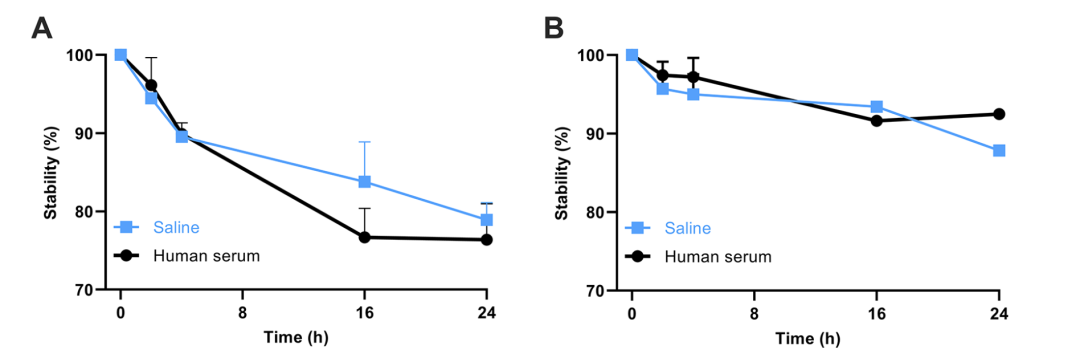
图2评估了 [211At]MABG在生理盐水和人血清中24小时的体外稳定性。A部分为在未添加抗坏血酸情况下,[211At]MABG在生理盐水与人血清中24小时的体外稳定性曲线;B部分为添加2.5%抗坏血酸钠后[211At]MABG的24小时体外稳定性变化。

图3比较了 [211At]NaAt、[211At]MABG和[131I]MIBG对于PC-12细胞的摄取与分布影响。A部分为PC-12细胞中[211At]NaAt与[211At]MABG的摄取对比,后者显著更高;B部分为[131I]MIBG和[211At]MABG在PC-12细胞中的摄取对比,后者在各时间点均优于前者;C部分展示了 [211At]MABG在2小时和24小时的亚细胞分布,2小时主要分布在细胞质,24小时进一步在细胞质累积。
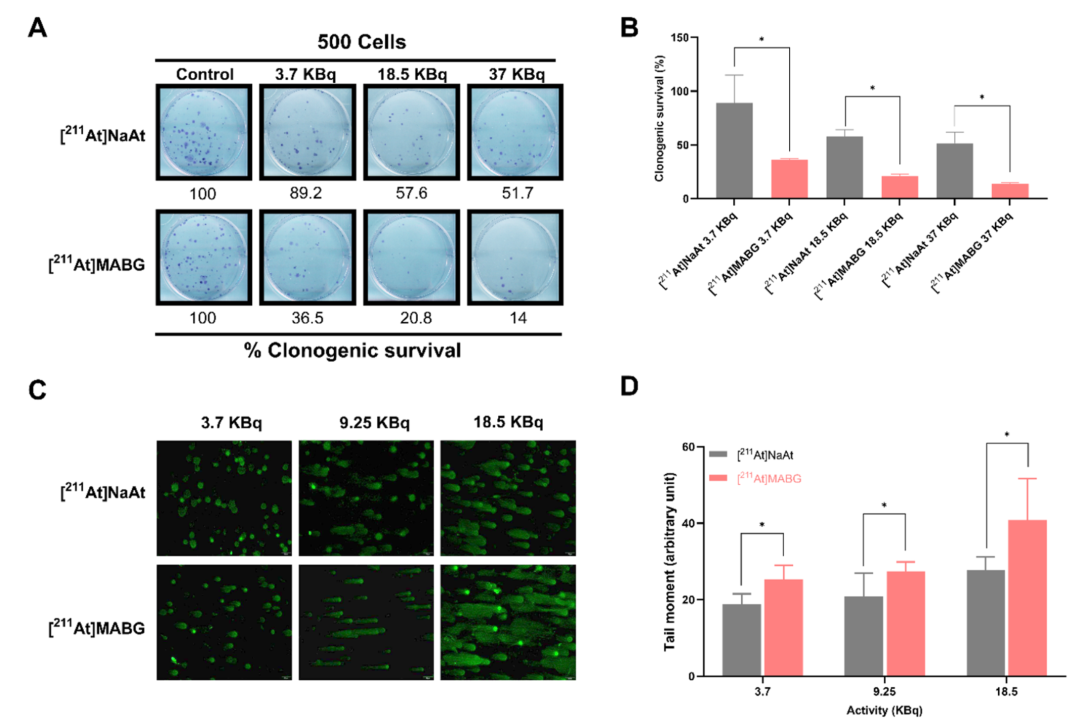
图4 评估了[211At]MABG对细胞增殖与DNA损伤的放射生物学效应。A部分为克隆形成实验图像,显示随着剂量增加,[211At]MABG处理组克隆显著减少;B部分为克隆形成实验的定量结果,与[211At]NaAt相比,[211At]MABG抑制效应更强;C部分为检测[211At]MABG和[211At]NaAt处理后PC-12细胞DNA断裂损伤效应的彗星实验代表性图像,显示[211At]MABG诱导有更明显的DNA拖尾;D部分为 [211At]MABG和[211At]NaAt对PC-12细胞中DNA链断裂影响的定量柱状图。该图证实了[211At]MABG通过高LET辐射显著诱导DNA损伤,具有优越杀伤效率。
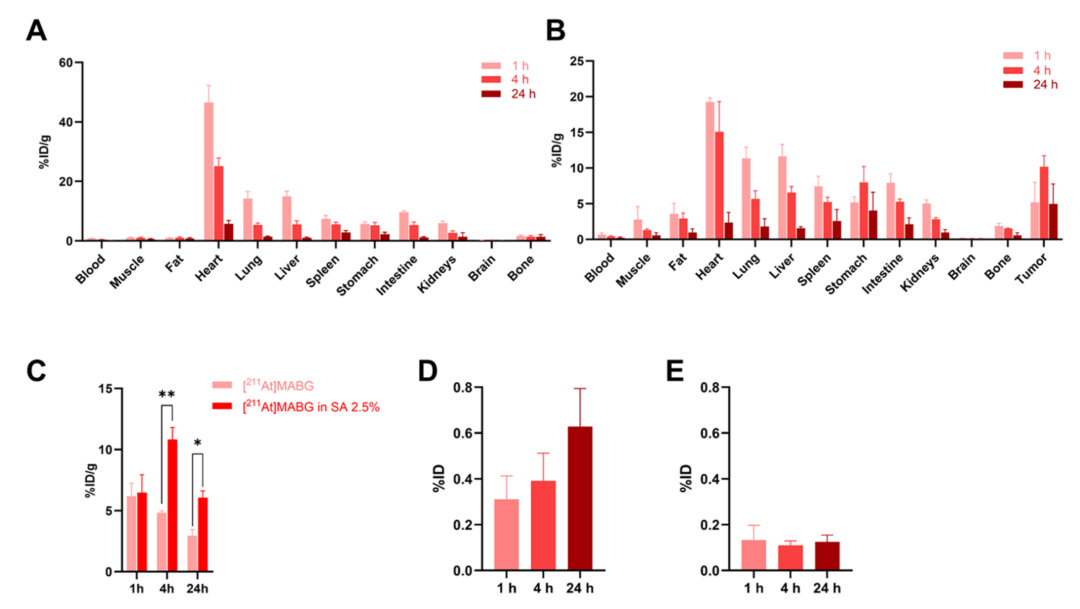
图5 展示了[211At]MABG在正常小鼠和荷瘤小鼠中的体内分布情况,并呈现了抗坏血酸对[211At]MABG体内分布和靶向性的优化作用。A部分为正常小鼠主要器官中的药物分布,心脏初期摄取高但快速清除;B部分为PC-12荷瘤小鼠中肿瘤及主要脏器摄取时间曲线,4小时在肿瘤中摄取达峰值;C部分对比了有/无抗坏血酸条件下的[211At]MABG肿瘤摄取,发现加入抗坏血酸后摄取更高更持久;D和E部分分别展示了未添加及添加抗坏血酸条件下,甲状腺中的[211At]MABG的累积变化,抗坏血酸显著降低了脱卤造成的甲状腺摄取。
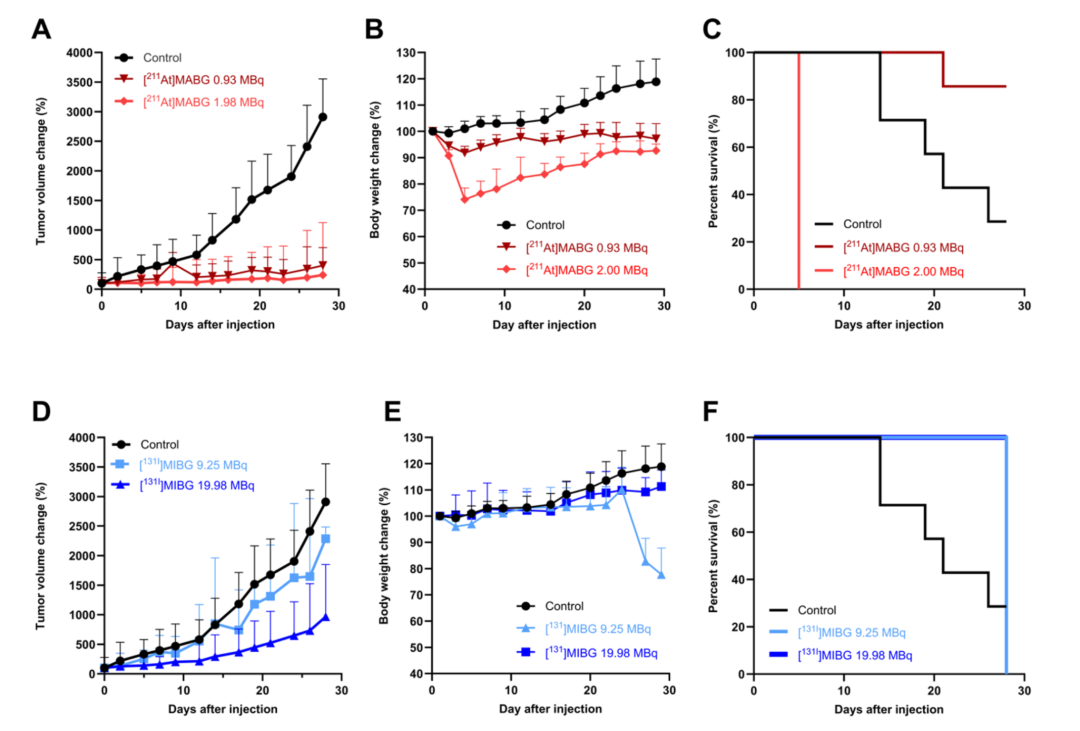
图6比较了[211At]MABG与[131I]MIBG在PC-12肿瘤小鼠模型中的抗肿瘤效果与毒性。A部分为阴性对照组及不同剂量[211At]MABG处理组肿瘤体积变化;B部分为阴性对照组及不同剂量[211At]MABG处理各组小鼠的体重变化,结果显示0.93 MBq组毒性低,体重保持良好; C部分为Kaplan-Meier生存曲线;D–F部分为接受对照、9.25 MBq 或19.98 MBq [131I]MIBG治疗的PC-12荷瘤小鼠的相应肿瘤体积变化、体重及生存曲线数据,虽然剂量更高但效果弱于[211At]MABG。该图系统对比了两种放射性药物的疗效与毒性,证实[211At]MABG在低剂量下表现出更佳的治疗窗口。
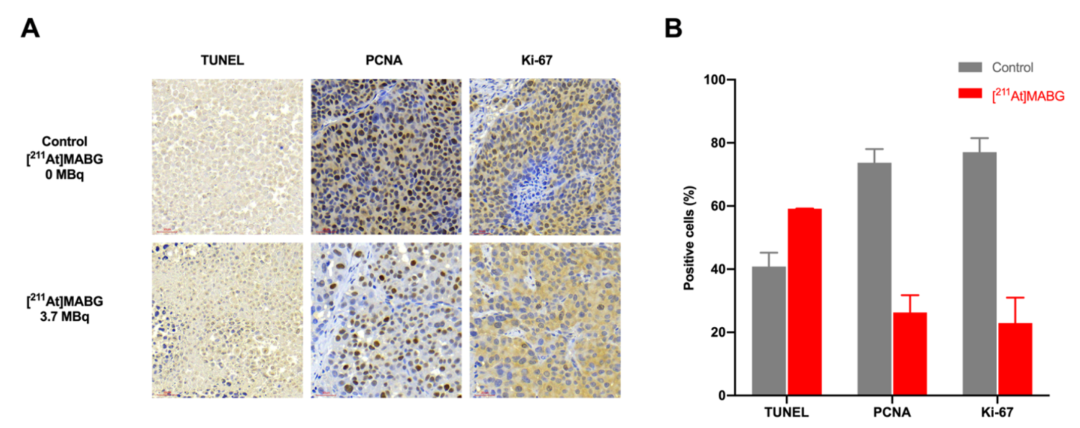
图7通过免疫组化分析验证了[211At]MABG的抗增殖与促凋亡机制。A部分展示了肿瘤组织的Ki-67、PCNA和TUNEL染色图像,在使用3.7MBq [211At]MABG处理后第2天,增殖相关指标(Ki-67和PCNA)下降,凋亡信号(TUNEL)增强;B部分展示了TUNEL、PCNA和Ki-67染色切片的定量分析,突出显示[211At]MABG处理组与对照组之间细胞凋亡和增殖的差异。该图验证了[211At]MABG通过显著抑制肿瘤细胞增殖并诱导凋亡,发挥其抗肿瘤效应的组织学依据。
03. 小结
本研究通过系统的“头对头”比较,全面评估了α核素药物[211At]MABG与β核素药物[131I]MIBG在嗜铬细胞瘤模型中的放射治疗性能。结果显示,[211At]MABG在细胞摄取、DNA损伤效应、肿瘤生长抑制及生存获益方面均表现出更优效果,尤其是在剂量显著降低(约为[131I]MIBG的1/20)条件下仍能维持良好疗效。此外,抗坏血酸的引入显著改善了[211At]MABG的体内稳定性,减少了脱卤导致的非靶向摄取,提升了其药物安全性与靶向性。
关于砹尔法纽克莱
砹尔法纽克莱(Alpha Nuclide)是中国首家专注于阿尔法核素生产供应的平台型企业。自2020年成立以来, 砹尔法围绕着阿尔法核素砹-211以及其他诊疗一体化核素, 建立了从早研到临床生产完整的平台, 并且在核素生产和核素药GMP级大规模生产等方向引领全球创新突破。砹尔法即将建成的华东生产中心装有两台30兆伏的回旋加速器, 为国内首创, 并且在核素生产方面具有完整的自主知识产权。预计于2025年建成后, 将彻底改变国内阿尔法核素供应局面。
宁波R&D总部:
地址:宁波前湾新区玉海东路136号
嘉兴同位素生产基地:
地址:嘉兴市海盐同位素产业园
电话:18902207829
邮箱: weibin.zhuo@astathera.com
官网:www.astathera.com



